CATALYST試験で新常識に|心房細動合併脳梗塞のDOACは「4日以内」開始へ
はじめに
心房細動(Atrial Fibrillation: AF)が原因の脳梗塞、その再発予防に不可欠な直接経口抗凝固薬(Direct Oral Anticoagulant: DOAC)。
その開始タイミングについての確立したエビデンスがなく、臨床現場での悩みの種でした。
早すぎれば出血性梗塞が怖い。
しかし、遅すぎれば早期の再発リスクに怯える日々…。
このジレンマに、ついに終止符を打つかもしれない決定的なエビデンスが登場しました。
今回は、2025年7月にLancet誌で発表された画期的な研究、CATALYST試験を深掘りし、
明日からの診療にどう活かすべきかを探ります。
なぜDOACの開始タイミングが重要なのか?
脳梗塞は、発症後早期の再発率が非常に高いことが知られています。
特に最初の2週間は危険な時期です。
そのため、一刻も早く抗凝固療法を開始し、次の塞栓を防ぎたいと考えるのが自然です。
しかし、脳梗塞の急性期は、梗塞巣が脆弱で出血性変化(Hemorrhagic Transformation)を起こしやすい状態でもあります。
抗凝固薬を早期に投与することで、この出血リスク、特に重篤な症候性頭蓋内出血(symptomatic ICH: sICH)を助長してしまうのではないか、という懸念が常にありました。
この「再発予防」と「出血リスク」のトレードオフをどうバランシングさせるか。
これまでELAN試験やTIMING試験など、いくつかの重要なランダム化比較試験(Randomized Controlled Trial: RCT)が行われてきましたが、結論は必ずしも明確ではありませんでした。
そこで登場したのが、今回ご紹介するCATALYST試験です。
この研究は、個々の試験結果を統合するだけでなく、個々の患者データ(Individual Patient Data: IPD)まで遡って統合・解析したIPDメタ解析という、非常に信頼性の高い手法を用いています。
このアプローチにより、これまでの疑問に対する、よりクリアな答えが示されました。
CATALYST試験の概要:デザインと結果
まずは、論文の根幹であるPICOから見ていきましょう。
PICO
- P (Patient): 急性期虚血性脳梗塞と心房細動を有する患者 5,441例
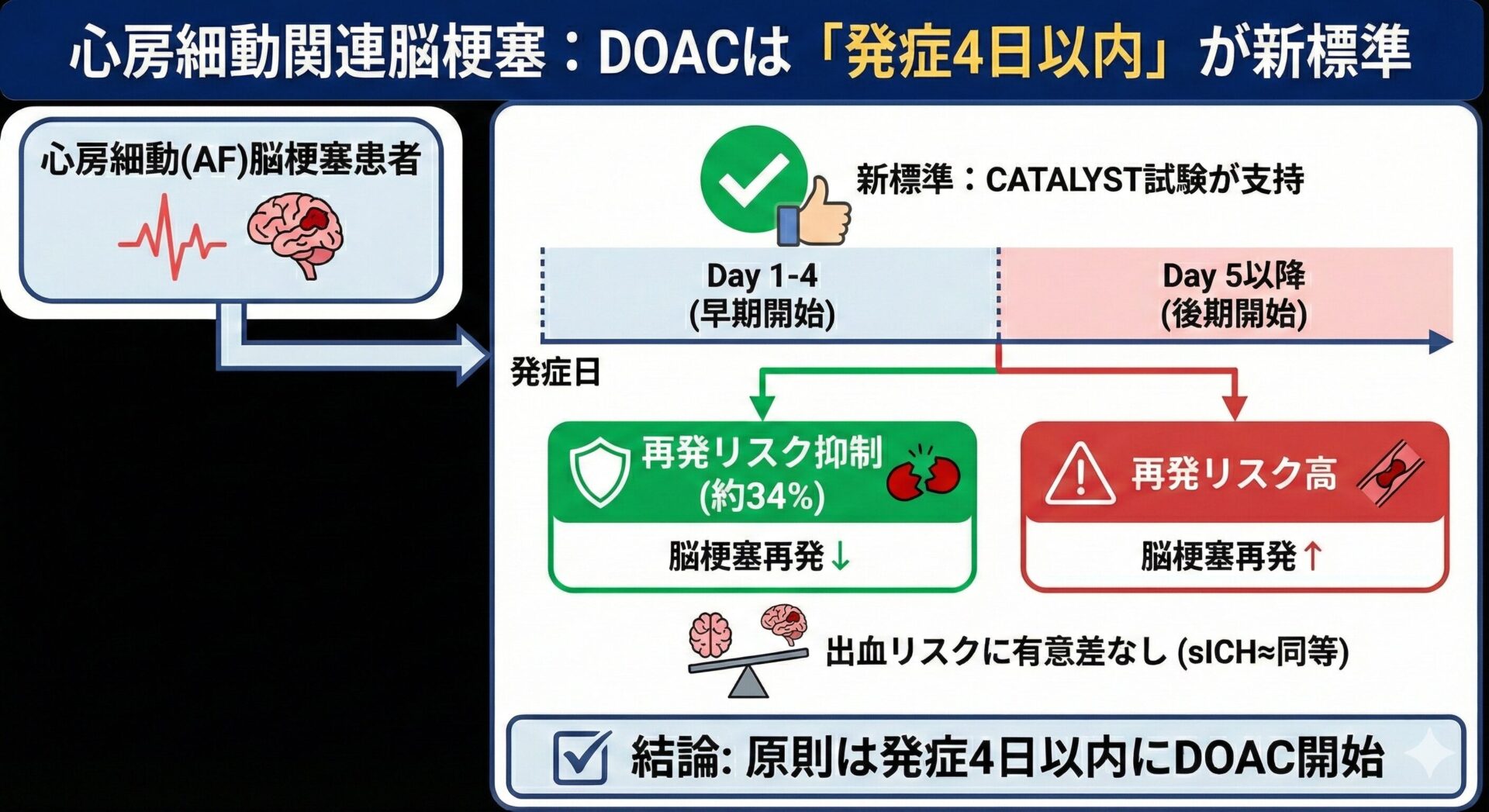
- I (Intervention): DOACの早期開始(発症 ≤ 4日)
- C (Comparison): DOACの後期開始(発症 ≥ 5日)
- O (Outcome): 30日時点での複合アウトカム(虚血性脳梗塞の再発、sICH、分類不能な脳卒中)
研究デザイン:IPDメタ解析の威力
CATALYSTは、TIMING、ELAN、OPTIMAS、STARTという4つの大規模RCTに参加した合計5,441例の患者データを統合したものです。
通常のメタ解析が「各論文の最終結果(要約統計量)」を統合するのに対し、
IPDメタ解析は「生データ」に近い個々の患者情報を集めて再解析します。
これにより、以下のような利点があります。
- より精緻なサブグループ解析: 例えば、重症度(NIH Stroke Scale: NIHSSスコア)別や年齢層別の効果をより正確に評価できます。
- 患者背景のばらつきの補正: 各研究間の基準の違いなどを調整しやすく、より均一な条件下での比較が可能になります。
この強力な手法により、CATALYSTは単独のRCTでは検出しきれなかった介入効果の差を明らかにしました。
結果:早期開始が明確に優位
結果は非常に明確でした。30日時点での主要複合アウトカムの発生率は、以下の通りです。
- 早期開始群: 2.1%
- 後期開始群: 3.0%
これを統計学的に見ると、オッズ比(Odds Ratio: OR)は0.70(95%信頼区間 0.50–0.98, p=0.039)となり、早期開始群で有意にイベントが少ないことが示されました。
各項目を個別に見てみましょう。
- 再発脳梗塞: 1.7% vs 2.6% (OR 0.66, 95%CI 0.45–0.96)
- 早期開始によって、脳梗塞の再発が約34%抑制されました。
- 症候性頭蓋内出血(sICH): 0.4% vs 0.4% (OR 1.02, 95%CI 0.43–2.46)
- 懸念されていた出血リスクは、両群で全く差がありませんでした。
この結果は「30日間で108人(Number Needed to Treat: NNT=108)に早期DOAC投与を行うことで、1件の主要アウトカムを防げる」と解釈されています。
研究の限界と批判的吟味
この素晴らしい結果にも、解釈上の注意点はあります。
このIPDメタ解析は、元のRCTに含まれた患者集団に基づいています。
つまり、以下のような患者は除外されているか、ごく少数しか含まれていません。
- 非常に重症な脳梗塞(例:NIHSS > 15-20)
- 広範囲な梗塞巣(例:中大脳動脈領域の1/3以上)
- 早期からの著明な出血性変化
したがって、こうしたハイリスク患者に対してこの結果をそのまま適応できるかは慎重に判断する必要があります。あくまでも個々の患者の病態や画像所見に基づいた臨床判断が重要であることは変わりません。
実臨床への活かし方:明日からどう動くか
このCATALYST試験の結果を受けて、私たちの日常診療はどう変わるべきでしょうか。
原則は「4日以内の開始」を標準に
これまでの「1-3-6-12日ルール」のようなExpert Opinionに基づく根拠のない基準から一歩進み、「出血リスクの低い患者では、原則として発症4日以内にDOACを開始する」という方針が新たなスタンダードになると考えられます。
特に、脳梗塞の規模が小〜中程度で、頭部CT/MRIで大きな出血性変化を認めない患者であれば、積極的に早期開始を検討すべきでしょう。
具体的な注意点
- t-PA(組織プラスミノーゲンアクチベータ)施行例:
アルテプラーゼなどの血栓溶解療法を行った場合、その後の出血リスク評価は必須です。
一般的には、投与から24時間後の画像検査で新たな出血がないことを確認した上で、DOAC開始を検討するのが安全なプラクティスです。 - 開始をためらう・遅らせるべき症例:
前述の通り、CATALYSTの対象から外れるようなハイリスク患者では、引き続き慎重な判断が求められます。- 広範囲な脳梗塞
- 早期からの明らかな出血性梗塞
- コントロール不良の高血圧(収縮期血圧 > 180mmHgなど)
- 緊急の外科的処置が必要な場合
これらのケースでは、個別にリスクとベネフィットを天秤にかけ、場合によっては5日以降の開始を検討することになります。
「こんな時どうする?」具体的な臨床シナリオ
シナリオ1:t-PA施行後の患者t-PA(アルテプラーゼ)を投与した患者さんでは、いつからDOACを開始すべきでしょうか? CATALYST試験の元となった各試験では、血栓溶解療法から24時間後の画像で大きな出血性変化がないことを確認した上で、DOACを開始するプロトコルが一般的でした。実臨床でもこの「24時間ルール」が一つの目安となります。
シナリオ2:広範囲な梗塞の患者(NIHSS > 15など)記事中の「研究の限界」でも触れた通り、CATALYST試験は広範囲梗塞の患者をほとんど含んでいません。このようなハイリスク症例では、引き続き個別の慎重な判断が必要です。頭部CTを頻回にフォローし、出血性変化の兆候がないかを確認しながら、後期開始(5日以降)を検討するのが安全策と考えられます。
シナリオ3:腎機能が悪い患者ダビガトランなど腎排泄型のDOACを使用する場合、腎機能の評価は不可欠です。CrCl < 30mL/minのような高度腎機能障害の患者は多くの臨床試験で除外されており、CATALYST試験の結果をそのまま適用するのは困難です。専門医へのコンサルトや、より安全域の広い薬剤選択が推奨されます。
患者さんへの説明
この新しいエビデンスを、患者さんやご家族に分かりやすく伝えることも重要です。
「最近、非常に信頼性の高い大規模な研究結果が出ました。それによると、脳梗塞後の再発を防ぐお薬(DOAC)は、発症から4日以内に早く始めた方が、再発を少し減らせることが分かりました。そして、心配される脳の出血のリスクは、早く始めても増えないことも確認されています。あなたの場合も、画像検査の結果から出血の心配は少ないため、明日からこのお薬を始めましょう。ただし、DOACを飲むことで出血合併症は生じやすくなるため、血圧の管理はしっかりと起こっていきましょう。」
Take Home Message
✅ 心房細動を合併した急性期脳梗塞では、DOACを「発症4日以内」に開始することが、新たな標準治療となる。
✅ この早期開始戦略は、脳梗塞の再発を有意に抑制し、かつ症候性頭蓋内出血のリスクを増加させないことが、質の高いIPDメタ解析によって示された。
今後のガイドライン改訂にも大きな影響を与えるであろう、ランドマーク的な研究です。
もちろん、すべての患者さんに一律に適用するのではなく、個々の病態を評価した上での判断が前提ですが、私たちの背中を力強く押してくれるエビデンスであることは間違いありません。
この記事が、先生方の日々の診療の一助となれば幸いです。
参考文献
- CATALYST Collaboration (Dehbi HM, Fischer U, Åsberg S, et al.). Collaboration on the optimal timing of anticoagulation after ischaemic stroke and atrial fibrillation: a systematic review and prospective individual participant data meta-analysis of randomised controlled trials (CATALYST). Lancet. 2025;406(10498):43–51. doi:10.1016/S0140-6736(25)00439-8.
PUBMED: https://pubmed.ncbi.nlm.nih.gov/40570866/ - Fischer U, Koga M, Strbian D, et al. Early versus Later Anticoagulation for Stroke with Atrial Fibrillation. N Engl J Med. 2023;388(26):2411-2421. doi:10.1056/NEJMoa2303048
PUBMED: https://pubmed.ncbi.nlm.nih.gov/37222476/ - Oldgren J, Åsberg S, Hijazi Z, et al. Early Versus Delayed Non–Vitamin K Antagonist Oral Anticoagulant Therapy After Acute Ischemic Stroke in Atrial Fibrillation (TIMING). Circulation. 2022;146(14):1056–1066. doi:10.1161/CIRCULATIONAHA.122.060666.
PUBMED: https://pubmed.ncbi.nlm.nih.gov/36065821/ - Werring DJ, Dehbi HM, Ahmed N, et al. Optimal timing of anticoagulation after acute ischaemic stroke with atrial fibrillation (OPTIMAS): a multicentre, blinded-endpoint, phase 4, randomised controlled trial. Lancet. Published online October 23, 2024. doi:10.1016/S0140-6736(24)02197-4
PUBMED: https://pubmed.ncbi.nlm.nih.gov/39491870/ - Warach SJ, Davis LA, Lawrence P, et al. Optimal Delay Time to Initiate Anticoagulation After Ischemic Stroke in Atrial Fibrillation: A Pragmatic, Response-Adaptive Randomized Clinical Trial. JAMA Neurol. 2025;82(5):470-476. doi:10.1001/jamaneurol.2025.0285
PUBMED: https://pubmed.ncbi.nlm.nih.gov/40163159/